Нейрохимическая основа шизофрении
- Дофаминовая теория шизофрении считается одной из ведущих нейробиологических гипотез, объясняющих этиологию и патогенез шизофрении1,2.
- В патологическом процессе задействованы различные дофаминовые рецепторы, их активность в различных зонах головного мозга может отличаться: патологическое снижение в одних отделах, чрезмерная активация – в других.
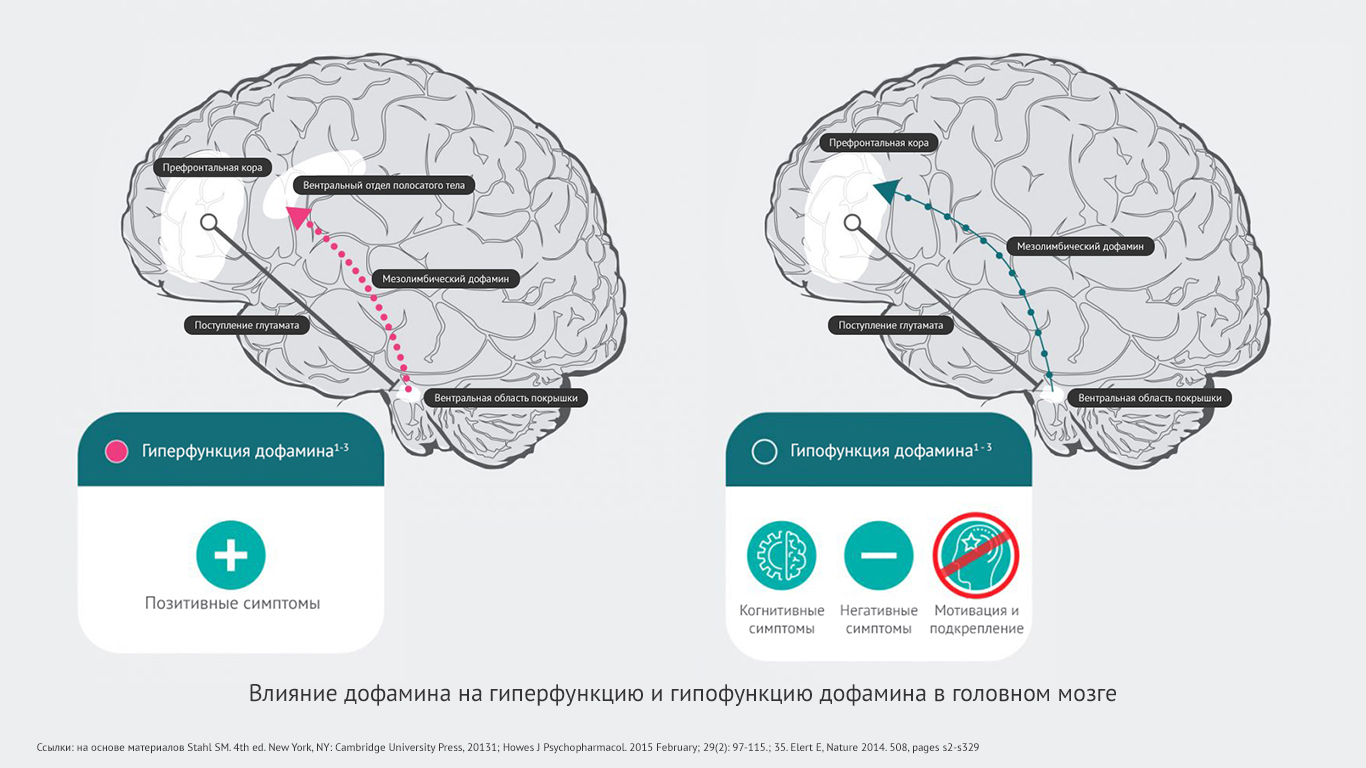
- Считается, что возникновение позитивных симптомов шизофрении может быть обусловлено гипердофаминергическим состоянием в мезолимбической системе. Появление негативных и когнитивных симптомов шизофрении может быть связано с гиподофаминергическим состоянием в мезокортикальной системе.
В настоящем разделе:
Дофаминовая теория
Данная гипотеза была основана на косвенных доказательствах – видимых изменениях в состоянии пациента на фоне лечения антипсихотическими препаратами.
Современное представление сформировалось в результате целенаправленных клинических наблюдений, что позволило лучше разобраться в патофизиологических механизмах течения шизофрении3.
Дофамин и функции головного
мозга 1,4-16
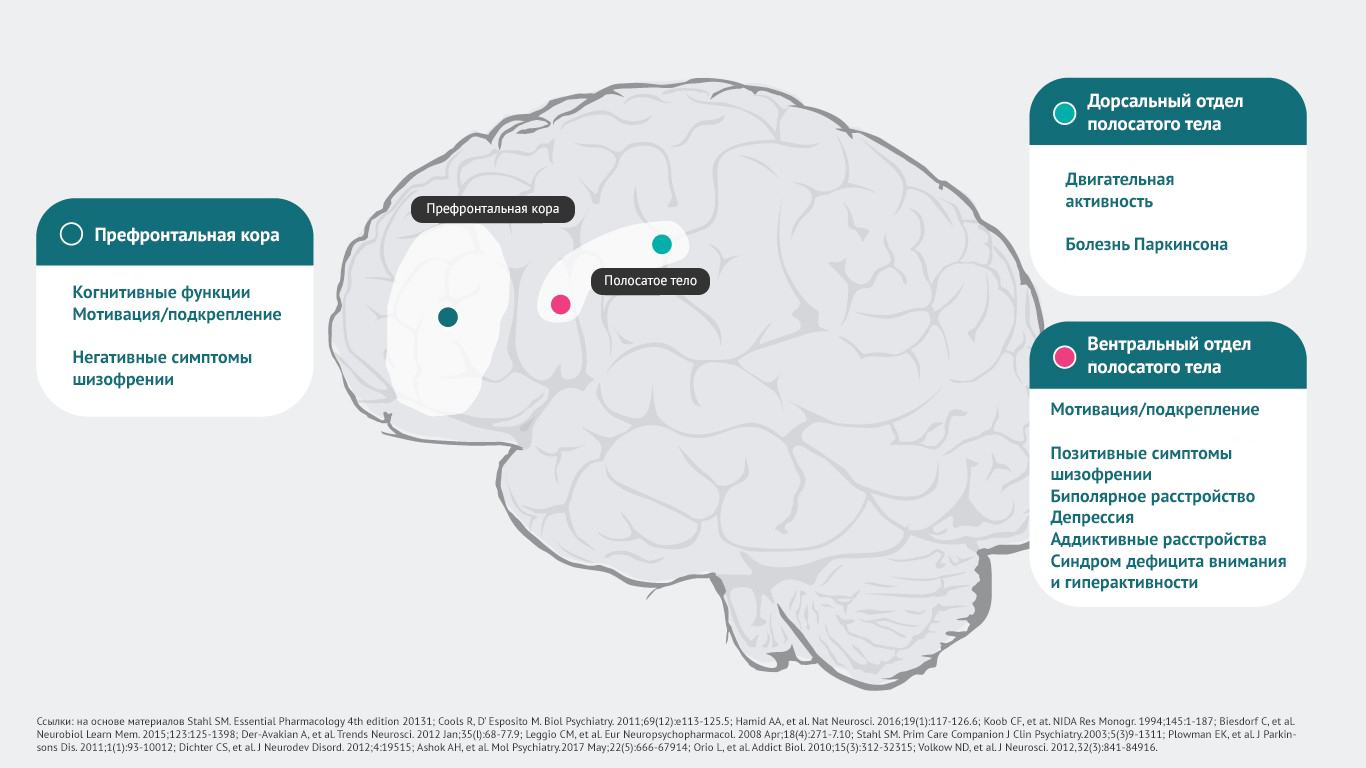
Дофамин оказывает влияние на большое количество рецепторов, которые задействованы в реализации психических, неврологических функций.
К примеру, можно выявить следующие взаимосвязи.
Область головного мозга – психические функции и возможные отклонения, которые могут возникнуть:
· префронтальная кора головного мозга – когнитивные функции5, мотивационная сфера, подкрепление6-10, негативные симптомы шизофрении11;
· дорсальный отдел полосатого тела – регуляция двигательной активности12, симптомы болезни Паркинсона1, дистония1;
· вентральный отдел полосатого тела – мотивационная сфера, подкрепление6-10, позитивные симптомы шизофрении11,13, симптомы биполярного расстройства4, депрессии8, аддиктивные расстройства14, синдром дефицита внимания и гиперактивности16.
Психотропные препараты, которые оказывают влияние на дофаминовые рецепторы могут облегчать симптомы психологических заболеваний.
Необходимо дальнейшее изучение влияния дофамина на отделы головного мозга для лучшего понимания особенностей действия антипсихотических препаратов в процессе терапии шизофрении4.
Подтипы дофаминовых рецепторов
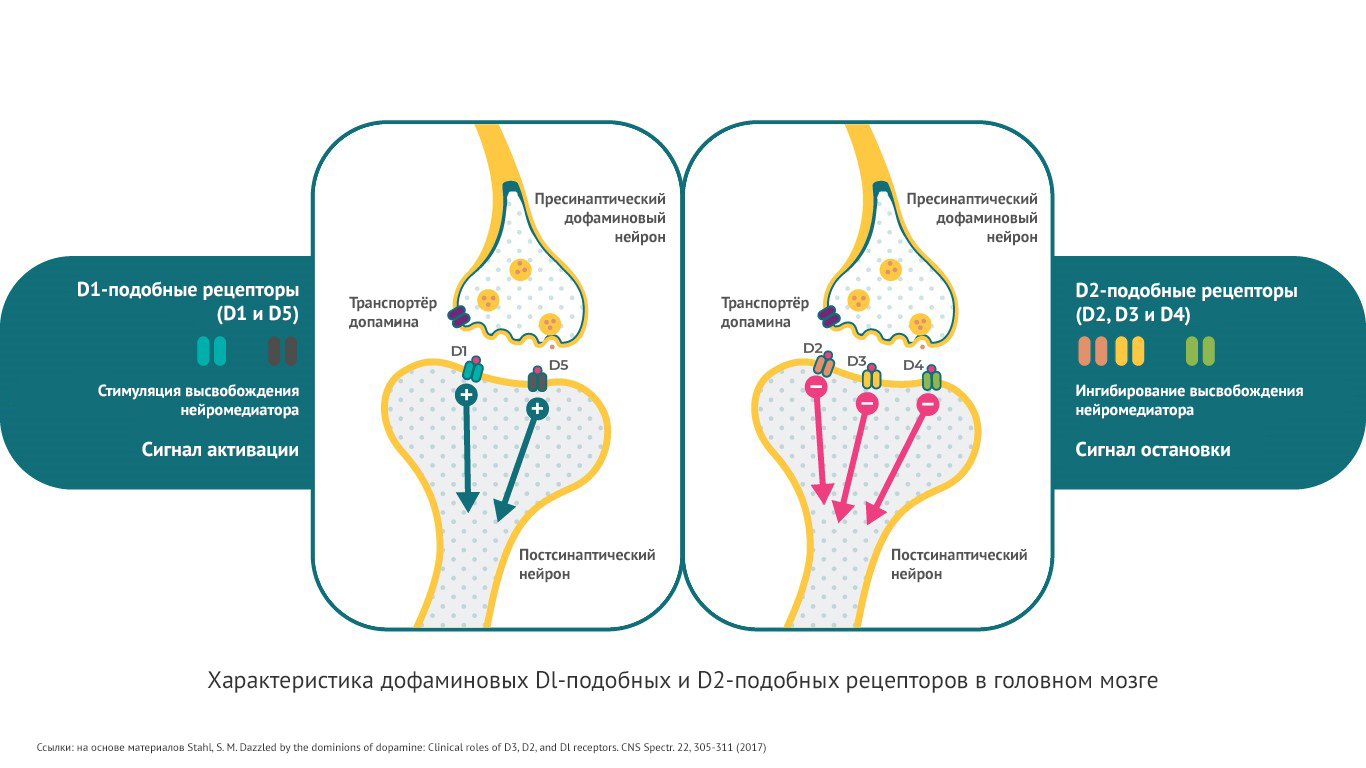
Существует 5 типов дофаминовых рецепторов. Их можно разделить на 2 основных группы:
· D1-подобные рецепторы. Это D1 и D5-рецепторы.
· D2-подобные рецепторы: D2, D3 и D4-рецепторы.
Принято считать, что патофизиологические процессы при шизофрении связаны с D2-, D3- и D1 – рецепторами.
Дофаминовые рецепторы могут оказывать различное действие на внутриклеточные сигналы молекулы (вторичные мессенджеры). Один тип рецепторов способен затормозить прохождение импульса, другие, наоборот активировать4. Так, D1-рецепторы стимулируют цАМФ (циклический аденозинмонофосфат), D2- и D3-рецепторы ингибируют этот вторичный мессенджер.
Таким образом, дофаминовые D1, D2 и D3-рецепторы влияют на различные нейробиологические функции. Это позволяет нейромедиатору дофамину контролировать различные физиологические, поведенческие и патологические состояния4,17.
Аффинность к дофаминовым рецепторам
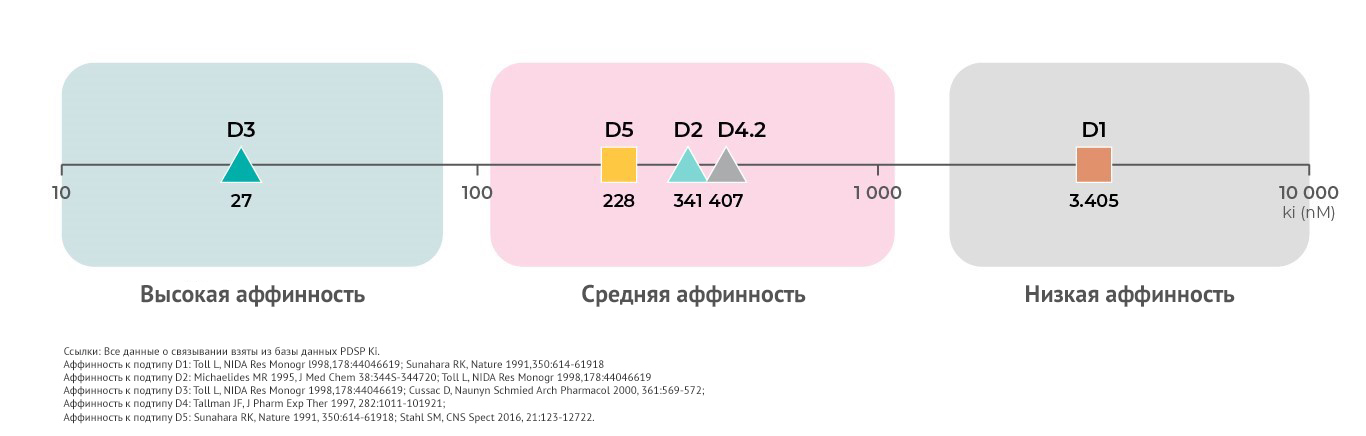
Каждый подтип дофаминовых рецепторов, кроме дифференциальных функций, обладает различной аффинностью к дофамину.
Согласно сведениям, которые содержатся в базе данных PDSP Ki, самой высокой аффинностью обладают дофаминовые D3- рецепторы19. Средней аффинностью обладают D219,20, D421 и D5- рецепторы18. Самая низкая аффинность у D1 – рецепторов4,18,19.
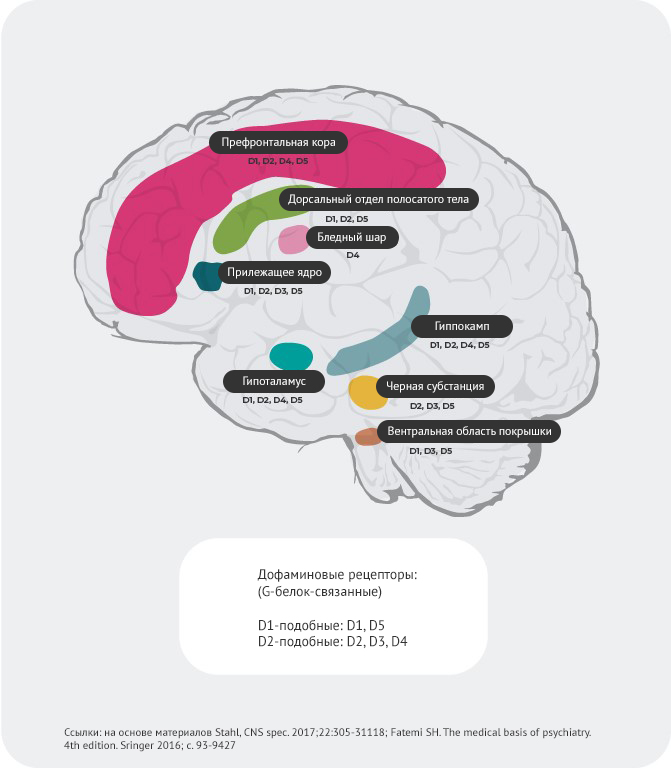
Распределение дофаминовых рецепторов4,22-27
Помимо различий в аффинности, наблюдается и особое распределение рецепторов в зависимости от их подтипа.
Например, предполагается, что гиперактивное высвобождение дофамина в постсинаптических D2-рецепторах в вентральном отделе полосатого тела провоцирует позитивные симптомы психоза. Как итог, дофаминовые D2-рецепторы представляют собой основную мишень для большинства антипсихотических препаратов, используемых для лечения шизофрении.
D3-рецепторы обнаруживаются в лимбической системе, гипоталамусе и вентральной области покрышки/черном веществе – областях, которые, как считается, участвуют в регуляции когнитивных функций, настроения и мотивации.
В префронтальной коре, где экспрессия дофаминовых D2 и D3-рецепторов незначительна, нейротрансмиссия дофамина более строго контролируется постсинаптическими D1-рецепторами.
Дофаминергические пути
В головном мозге человека существует 4 основных дофаминергических пути: мезолимбический, мезокортикальный, нигростриарный и тубероинфундибулярный пути27:
Мезолимбический путь: также известный как путь подкрепления, отвечает за передачу дофамина из вентральной области покрышки (ВОП) в вентральный отдел полосатого тела. Вентральная область покрышки расположена в среднем мозге, а вентральный отдел полосатого тела – в переднем мозге, и включает прилежащее ядро и обонятельный бугорок;
Мезокортикальный путь: как считается, участвует в когнитивных функциях и эмоциях, отвечает за передачу дофамина из вентральной области покрышки в префронтальную кору;
Нигростриарный путь: нигростриарный путь, участвует в регуляции моторики, отвечает за передачу дофамина из области черной субстанции, расположенной в среднем мозге, в хвостатое ядро и базальное ядро (путамен), которые находятся в дорсальном отделе полосатого тела;
Тубероинфундибулярный путь: отвечает за передачу дофамина из аркуатного ядра медиобазального гипоталамуса в гипофиз. Этот путь регулирует секрецию гормонов гипофиза, в том числе пролактина.
Дофамин и шизофрения28,29
Дофаминовая гипотеза шизофрении говорит о том, что гиперактивная нейротрансмиссия дофамина в подкорковых и лимбических областях головного мозга связана с позитивными симптомами шизофрении30.
Гипофункциональность мезокортикальных проекций дофамина в префронтальную кору может в большей степени отвечать за негативные и когнитивные симптомы шизофрении31,32.
Для объяснения нарушений регуляции дофамина, которые могут лежать в основе патофизиологии шизофрении, было предложено несколько теорий33,44.
Так, исследования показали, что появление симптомов болезни может быть связано с нарушением регуляции глутамата, которое приводит к дофаминергическому дисбалансу35.
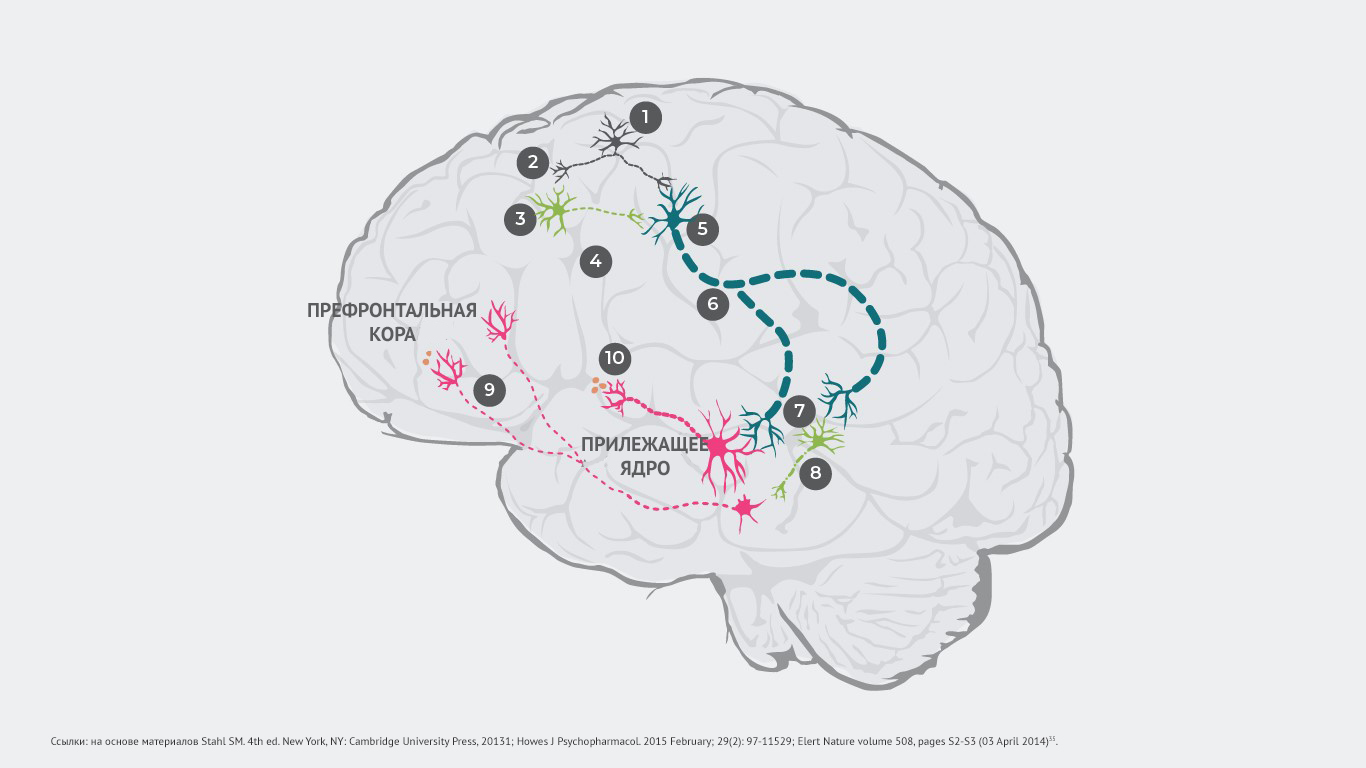
Патологический процесс запускает возбуждение глутаматных нейронов и передачу электрического импульса (№1), который вызывает высвобождение глутамата в синапсе (№2).
В норме глутамат связывается с рецепторами, ингибирующими ГАМК (гамма-аминомасляную кислоту) и возбуждающими глутаматными нейронами. Но у пациентов с шизофренией нарушается связывание глутамата с ГАМК-нейронами (№3), в результате чего не высвобождаются ингибиторные нейротрансмиттеры (№4). При этом связывание глутамата с возбуждающими глутаматными нейронами происходит даже при отсутствии ингибирующих ГАМК-нейронов (№5). После чего усиленный сигнал направляется в ствол головного мозга (№6).
Как следствие, в синапсе высвобождается слишком большое количество глутамата, который активирует как дофаминовые нейроны, так и другие ингибирующие ГАМК-нейроны (№7).
Чрезмерно стимулированные нейроны ГАМК избыточно ингибируют другие дофаминовые нейроны, тем самым подавляя их активность (№8). Такой гипоактивный дофаминовый нейрон передает прерывистые сигналы из вентральной области покрышки в префронтальную кору. Высвобождается минимальное количество дофамина (№9). Развивается гиподофаминергическое состояние в мезокортикальной системе. А оно способно провоцировать появление негативных симптомов шизофрении1.
Гиперстимулированные дофаминовые нейроны передают усиленные сигналы из вентральной области покрышки в вентральный отдел полосатого тела. Происходит чрезмерное высвобождение дофамина в этой области (№10). Это приводит к гипердофаминергическому состоянию в мезолимбической системе, что может провоцировать позитивные симптомы шизофрении1.
Исследования подтверждают, что увеличение нейротрансмиссии дофаминовых D2-рецепторов в подкорковой и лимбической области мозга может способствовать проявлению позитивных симптомов шизофрении31,32.
Но стоит помнить, что механизмы, вызывающие негативные и когнитивные симптомы шизофрении, все еще недостаточно изучены.
В настоящее время предполагается, что пониженное высвобождение дофамина в префронтальной коре вызывается активацией пресинаптических дофаминовых D3-ауторецепторов в вентральной области покрышки, которая связана с префронтальной корой.
Среди различных подтипов дофаминовых рецепторов D3-рецепторы обладают наибольшей аффинностью к дофамину.
В отличие от D1 или D2-рецепторов, стимуляция D3-рецепторов возможна даже в условиях сниженного высвобождения дофамина. Это может влиять на случайные выбросы дофамина.
Блокировка этого ослабления препятствует ингибированию высвобождения дофамина и усиливает нейротрансмиссию.
Это увеличение количества дофамина может устранить гиподофаминергическое состояние и привести к облегчению негативных и когнитивных симптомов шизофрении посредством активации D1-рецепторов в префронтальной коре, которые не активны в условиях низкого уровня дофамина32.
Во время опытов на животных, включая исследования на приматах, было показано, что оптимальный эффект в отношении улучшения когнитивных функций, достигается при оптимизации активности D1-рецептора в префронтальной коре.
Избыточное количество дофамина, а также его недостаточное количество в кортикальных D1-рецепторах может быть связано с когнитивной дисфункцией.
Есть предположение, что лекарственные препараты, блокирующие или чрезмерно стимулирующие D1-рецепторы, могут провоцировать нарушение баланса нейротрансмиссии дофамина в корковых синапсах и вызывать когнитивные, негативные симптомы шизофрении, аффективные расстройства.
Также возможно, что антагонисты D3-рецепторов могут препятствовать ингибированию высвобождения дофамина и гармонизировать кортикальные цепи. Данное действие потенциально способно регулировать выраженность когнитивных, негативных симптомов шизофрении, аффективных расстройств4.
Источники:
- Stahl, S. M. Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. (Cambridge University Press, 2013).
- Seeman, P. Schizophrenia and dopamine receptors. Eur. Neuropsychopharmacol. 23, 999–1009 (2013).
- Kaar, S. J., Natesan, S., McCutcheon, R. & Howes, O. D. Antipsychotics: Mechanisms underlying clinical response and side-effects and novel treatment approaches based on pathophysiology. Neuropharmacology (2019). doi:10.1016/j.neuropharm.2019.107704
- Stahl, S. M. Dazzled by the dominions of dopamine: Clinical roles of D3, D2, and D1 receptors. CNS Spectr. 22, 305–311 (2017).
- Cools, R. & D’Esposito, M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry 69, e113-125 (2011).
- Hamid, A. A. et al. Mesolimbic dopamine signals the value of work. Nat. Neurosci. 19, 117-126. (2016).
- Koob, G. F., Caine, B., Markou, A., Pulvirenti, L. & Weiss, F. Role for the mesocortical dopamine system in the motivating effects of cocaine. NIDA Res. Monogr. Ser. 145, 1-18. (1994).
- Biesdorf, C. et al. Dopamine in the nucleus accumbens core, but not shell, increases during signaled food reward and decreases during delayed extinction. Neurobiol. Learn. Mem. 123, 125–139 (2015).
- Der-Avakian, A. & Markou, A. The neurobiology of anhedonia and other reward-related deficits. Trends Neurosci. 35, 68–77 (2012).
- Leggio, G. M., Micale, V. & Drago, F. Increased sensitivity to antidepressants of D3 dopamine receptor-deficient mice in the forced swim test (FST). Eur. Neuropsychopharmacol. 18, 271–277 (2008).
- Stahl, S. M. Describing an atypical antipsychotic: receptor binding and its role in pathophysiology. Prim. Care Companion J. Clin. Psychiatry 5, 9–13 (2003).
- Plowman, E. K., Thomas, N. J. & Kleim, J. A. Striatal dopamine depletion induces forelimb motor impairments and disrupts forelimb movement representations within the motor cortex. J. Parkinsons. Dis. 1, 93–100 (2011).
- Dichter, G. S., Damiano, C. A. & Allen, J. A. Reward circuitry dysfunction in psychiatric and neurodevelopmental disorders and genetic syndromes: Animal models and clinical findings. J. Neurodev. Disord. 4, 19 (2012).
- Ashok, A. H. et al. The dopamine hypothesis of bipolar affective disorder: The state of the art and implications for treatment. Mol. Psychiatry 22, 666–679 (2017).
- Orio, L., Wee, S., Newman, A. H., Pulvirenti, L. & Koob, G. F. The dopamine D3 receptor partial agonist CJB090 and antagonist PG01037 decrease progressive ratio responding for methamphetamine in rats with extended-access. Addict. Biol. 15, 312–323 (2010).
- Volkow, N. D. et al. Methylphenidate-elicited dopamine increases in ventral striatum are associated with long-term symptom improvement in adults with attention deficit hyperactivity disorder. J. Neurosci. 32, 841–849 (2012).
- Beaulieu, J. M., Espinoza, S. & Gainetdinov, R. R. Dopamine receptors – IUPHAR review 13. Br. J. Pharmacol. 172, 1–23 (2015).
- Sunahara, R. K. et al. Cloning of the gene for a human dopamine D5 receptor with higher affinity for dopamine than D1. Nature 350, 614–619 (1991).
- Toll, L. et al. Standard binding and functional assays related to medications development division testing for potential cocaine and opiate narcotic treatment medications. NIDA Res. Monogr 178, 440–466 (1998).
- Michaelides, M. R. et al. (5aR, 11bS)-4,5,5a,6,7, 11b-hexahydro-2-propyl-3-thia-5-azacyclopent-1-ena[c]-phenanthrene-9,10-diol (A-86929): A potent and selective dopamine D1 agonist that maintains behavioral efficacy following repeated administration and characterization of its dia. J. Med. Chem. 38, 3445–3447 (1995).
- Tallman, J. F. et al. Ngd 94-1 – identification of a noval, high-affinity antagonist at the human dopamine D-4 receptor 1. J. Pharmacol Exp Ther 282, 1011–1019 (1997).
- Stahl, S. M. Mechanism of action of cariprazine. CNS Spectr. 21, 123–127 (2016).
- Gurevich, E. V. & Joyce, J. N. Distribution of dopamine D3 receptor expressing neurons in the human forebrain comparison with D2 receptor expressing neurons. Neuropsychopharmacology 20, 60–80 (1999).
- Mengod, G. et al. Visualization of dopamine D1, D2 and D3 receptor mRNA’s in human and rat brain. Neurochem. Int. 20, Suppl:33S-43S (1992).
- Meador-Woodruff, J. H. et al. Dopamine receptor mRNA expression in human striatum and neocortex. Neuropsychopharmacology 15, 17–29 (1996).
- Fuxe, K. et al. Dopaminergic Systems in the Brain and Pituitary. in Basic and Clinical Aspects of Neuroscience (eds. Flückinger, E., Müller, E. E. & Thorner, M. O.) (Springer, 1985). doi:10.1007/978-3-642-69948-1_2
- Fatemi, S. H. & Clayton, P. J. The medical basis of psychiatry: Fourth edition. The Medical Basis of Psychiatry: Fourth Edition (2016). doi:10.1007/978-1-4939-2528-5
- Howes, O. D. & Kapur, S. The dopamine hypothesis of schizophrenia: Version III – The final common pathway. Schizophr. Bull. 35, 549–562 (2009).
- Howes, O., McCutcheon, R. & Stone, J. Glutamate and dopamine in schizophrenia: An update for the 21st century. J. Psychopharmacol. 29, 97–115 (2015).
- Desbonnet, L. Modeling the Psychopathological Dimensions of Schizophrenia. in Handbook of Behavioural Neuroscience 267–284 (2016).
- Toda, M. & Abi-Dargham, A. Dopamine hypothesis of schizophrenia: Making sense of it all. Curr. Psychiatry Rep. 9, 329–336 (2007).
- Stahl, S. M. Drugs for psychosis and mood: Unique actions at D3, D2, and D1 dopamine receptor subtypes. CNS Spectr. 22, 375–384 (2017).
- Grace, A. A. & Gomes, F. V. The circuitry of dopamine system regulation and its disruption in schizophrenia: Insights into treatment and prevention. Schizophr. Bull. 45, 148–157 (2019).
- Grace, A. A. Dysregulation of the dopamine system in the pathophysiology of schizophrenia and depression. Nat. Rev. Neurosci. 17, 524–532 (2016).
- Elert, E. Aetiology: Searching for schizophrenia’s roots. Nature 508, S2-3 (2014).
CNS Spectrums
Удивительное доминирование дофамина: клиническая роль D3, D2 и D1-рецепторов
Механизм действия препарата Реагила Механизм действия препарата Реагила
Терапевтический эффект карипразина обеспечивается комбинацией частичного агонизма по отношению к дофаминовым D3- и D2-рецепторам и серотониновым Узнайте больше о механизме действия препарата Реагила
далее…Механизм действия антипсихотиков Механизм действия антипсихотиков
Клиническая эффективность типичных антипсихотических препаратов, судя по всему, зависит от высокой аффинности и полной антагонистической активности в отношении Клиническая эффективность типичных антипсихотических препаратов, судя по всему, зависит от высокой аффинности и полной антагонистической активности в отношении
далее…